據《科創(chuàng )板日報》記者觀(guān)察,今年已來(lái),已有澤璟制藥-U、神州細胞-U、前沿生物-U三家公司更新了新冠管線(xiàn)動(dòng)態(tài)。這三家醫藥企業(yè)們押注新冠特效藥是出于怎樣的考慮呢?適應癥的變化又意味著(zhù)什么呢?
《科創(chuàng )板日報》6月16日(記者 金小莫),輝瑞明星新冠治療藥物Paxlovid又一次臨床失敗。而與此同時(shí),《科創(chuàng )板日報》記者注意到,今年以來(lái)已有多家科創(chuàng )板醫藥公司陸續拿到了新冠特效藥的臨床批件,這樣的“前赴后繼”是否值得?
15日,輝瑞宣布,其新冠口服藥Paxlovid在對一般風(fēng)險人群的臨床試驗中失敗。這已經(jīng)不是Paxlovid首次臨床失敗,在今年4月末,輝瑞宣布Paxlovid針對暴露后預防的EPIC-PEP研究也未能達到主要終點(diǎn)。
所謂“一般風(fēng)險人群”是指:未接種疫苗的成年人、具有一種或多種進(jìn)展為重癥疾病風(fēng)險因素的已接種疫苗成年人。記者了解到,若被新冠病毒感染后,他們往往容易發(fā)展成為重癥患者,因此對相關(guān)治療藥物的需求同樣迫切。
而這一市場(chǎng)也吸引著(zhù)科創(chuàng )板上的生物醫藥企業(yè)——
據《科創(chuàng )板日報》記者觀(guān)察,今年已來(lái),已有澤璟制藥-U(688266.SH)、神州細胞-U(688520)、前沿生物-U(688221.SH)三家公司更新了新冠管線(xiàn)動(dòng)態(tài)。此外,神州細胞、前沿生物近期披露的定增公告顯示,二者分別擬募資4.57億元、3億元用于前述產(chǎn)品的開(kāi)發(fā)。
進(jìn)一步梳理發(fā)現,這三家企業(yè)所開(kāi)發(fā)的新冠特效藥,其適用人群主要是新冠重癥患者(記者注:由于重癥患者需要住院治療,因此重癥患者也即住院患者)。此前,輝瑞的Paxlovid、默沙東的Molnupiravir、君實(shí)生物-U(688180.SH)的VV116、真實(shí)生物的阿茲夫定等新冠特效藥,都曾受到市場(chǎng)關(guān)注,不過(guò),它們的適用人群大多是輕、中癥新冠患者。
這三家醫藥企業(yè)們押注新冠特效藥是出于怎樣的考慮呢?適應癥的變化又意味著(zhù)什么呢?《科創(chuàng )板日報》記者對相關(guān)公司進(jìn)行了采訪(fǎng)。
多家科創(chuàng )板醫藥公司進(jìn)入新冠特效藥賽道
具體來(lái)看,前述三家科創(chuàng )板公司中,
澤璟制藥于6月1日公告稱(chēng),公司自主研發(fā)的鹽酸杰克替尼片用于治療重型新型冠狀病毒肺炎患者的臨床試驗申請已獲得到國家藥品監督管理局受理。
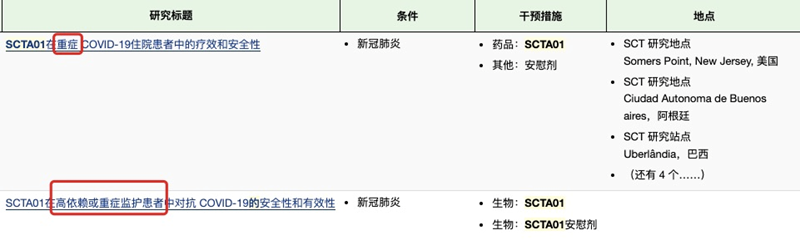
神州細胞則在于4月30日披露的《2021年度向特定對象發(fā)行A股股票募集說(shuō)明書(shū)》中披露稱(chēng),公司的新型冠狀病毒(SARS-CoV-2)中和抗體藥物SCTA01已完成I期臨床試驗研究,正在開(kāi)展2項新冠患者的國際多中心II/III期臨床研究。
記者查詢(xún)臨床研究數據庫獲悉,SCTA01的招募患者為重癥新冠住院患者。
4月28日,前沿生物也公告稱(chēng),國家藥品監督管理局藥品審評中心同意其新冠小分子藥物FB2001開(kāi)展II/III期國際多中心臨床試驗,適用人群為新冠肺炎住院患者。
總體來(lái)看,前述三家企業(yè)新冠藥的適用人群均系新冠重癥患者,研究階段則普遍處于早期。
澤璟制藥對《科創(chuàng )板日報》記者表示,(公司的)杰克替尼作為JAK抑制劑,治療機制明確,獲得臨床批件之后,萬(wàn)一出現大流行和高毒性病毒時(shí)可以盡快臨床試驗,從而筑牢防疫底線(xiàn)和滿(mǎn)足急需的治療需求。
相較之下,前沿生物、神州細胞的推進(jìn)力度則更大一些,二者分別擬定增3億元、4.57億元用于前述產(chǎn)品的開(kāi)發(fā)。
另?yè)襟w報道,6月15日,前沿生物的FB2001通過(guò)霧化吸入給藥的方式,用于治療新冠密接者暴露后預防的臨床研究也已在上海瑞金醫院?jiǎn)?dòng)。
新冠重癥存在臨床需求
為什么這幾家企業(yè)都要集中研發(fā)適用于重癥新冠患者的特效藥?分析推測,可能還是由于這一適應癥仍存市場(chǎng)空白。
如前文所述,無(wú)論進(jìn)口藥物Paxlovid、Molnupiravir、還是國產(chǎn)的VV116、阿茲夫定,目前主要治療的適應癥還是新冠輕、中癥患者。但在治療新冠重癥患者方面,目前,全球僅有吉利德的Remdesivir(瑞德西韋)已在部分國家獲批可用于治療這部分人群。
同時(shí),有行業(yè)分析師認為,在新冠賽道中,相較于治療輕癥患者,能夠治療重癥患者的特效藥會(huì )更有臨床需求。“大多數新冠陽(yáng)性患者為輕癥,普遍可以自愈,而且疫苗的接種也可以有效阻止患者的病情由輕癥轉重癥。”對方向記者表示。
澤璟制藥亦向《科創(chuàng )板日報》記者表示,新冠病毒還在不斷變異,近期國外感染數據已顯示變體BA.4和BA.5感染人數在迅速增加。針對新冠防疫,我們國家的應對是:疫苗和藥物。特別是針對重癥肺炎患者,目前急需治療藥物。
另外,銷(xiāo)售數據也部分佐證了對于重癥特效藥的需求存在。據吉利德與輝瑞的2022年一季報,報告期內,吉利德的瑞德西韋共銷(xiāo)售了15億美元,并不輸于輝瑞的Paxlovid,后者于2022年Q1銷(xiāo)售了14.7億美元。
市場(chǎng)空間有多大?
另一方面,由于大多數新冠陽(yáng)性患者為輕癥,重癥藥物的市場(chǎng)需求又能有多大呢?
《科創(chuàng )板日報》記者聯(lián)系到前沿生物,后者進(jìn)一步向記者闡釋了這背后的邏輯:
“雖然奧密克戎的致死率大為降低,但感染率也大幅提升了,這致使全球上百萬(wàn)人感染,其中有大量的脆弱人群,他們或者是老年人群、或者是有嚴重的基礎性疾病的人群等,后者感染新冠病毒后,往往容易轉重癥并需要住院治療。雖然重癥的比率低,但人口基數大,所以重癥的患者如數并不低。如果有特效藥的話(huà),全面放開(kāi)后,對基層醫療體系的壓力會(huì )減輕很多。”
為查證企業(yè)所言,《科創(chuàng )板日報》記者進(jìn)一步查詢(xún)了相關(guān)數據。
其中,刊登于中國疾病預防控制中心周報(CCDC Weekly)上的一項研究結果,較為相關(guān)。

該研究由北京大學(xué)健康醫療大數據國家研究院賈忠偉教授的研究團隊進(jìn)行。他們表示:對于當前中國這種基本沒(méi)有疫情的國家而言,如果放寬防疫限制措施,即恢復人口流動(dòng),可能會(huì )在一年內出現超過(guò)2.34億感染病例和200萬(wàn)死亡病例。
假設一年內新增200萬(wàn)有死亡風(fēng)險的重癥新冠患者,這又是什么概念呢?數據顯示,目前全球第一大腫瘤為乳腺癌,后者在中國每年的新增患者數為42萬(wàn)人。
不過(guò),《科創(chuàng )板日報》記者從業(yè)內獲悉,鑒于國內采取了較為嚴格的防疫措施(包括佩戴口罩、限制流動(dòng)性等),這有效限制了新冠病毒的傳播速度,也使得重癥患者數量相對較低,對藥物開(kāi)發(fā)方來(lái)說(shuō),會(huì )出現“招不到足夠的重癥患者人數”的情況。企業(yè)要想招募到足夠的人數,唯有去海外做臨床試驗,這又造成了高昂的臨床開(kāi)發(fā)成本。
或也是鑒于此,前沿生物、神州細胞則紛紛定增進(jìn)行國際多中心的臨床試驗。
相關(guān)藥物各有特點(diǎn)
神州細胞的SCTA01、前沿生物的FB2001誰(shuí)又能率先“出圈”呢?
由于缺乏臨床數據支撐,目前下結論還為時(shí)過(guò)早。從現有資料來(lái)看,兩款藥物各有特色。
其中,神州細胞的SCTA01系中和抗體。據了解,該藥物通過(guò)高親和力結合病毒刺突蛋白(S 蛋白)的受體結合區域(RBD),封閉病毒與宿主受體ACE2結合,抑制感染細胞融合形成合胞體,有效降低患者體內的病毒含量,降低肺炎等癥狀。
前沿生物FB2001為蛋白酶抑制劑,靶向3CL蛋白酶,與輝瑞的Paxlovid系同一靶點(diǎn)。在定增公告中,前沿生物表示,FB2001具有廣譜抗病毒活性,相關(guān)研究數據已發(fā)表于國際權威期刊《科學(xué)》(Science)并作為封面文章刊登,而且FB2001無(wú)需聯(lián)用藥代激動(dòng)劑。
企業(yè)進(jìn)一步對《科創(chuàng )板日報》記者介紹稱(chēng),公司基于長(cháng)年研發(fā)抗病毒藥物的經(jīng)驗,認為3CL蛋白酶是“非常可靠的靶點(diǎn)”,“我們曾經(jīng)在研發(fā)抗艾滋病毒的藥物中驗證過(guò)這一靶點(diǎn),有相關(guān)數據”,并已在2020年1月已開(kāi)始了相關(guān)的藥物研發(fā)。
“其實(shí)我們是全球最早開(kāi)發(fā)新冠特效藥的企業(yè)之一,但公司資源有限,一度影響了推進(jìn)速度,目前正在積極推動(dòng)。”前沿生物稱(chēng),其已與全球最大的CRO企業(yè)簽訂了合同,計劃在全球20多個(gè)國家的200多個(gè)臨床試驗點(diǎn)開(kāi)展臨床,將“盡快開(kāi)始、全面推進(jìn)”。
“希望到今年年底的時(shí)候,可以拿到中期試驗數據分析,以支持公司于今年底、明年初申報緊急使用授權(EUA)。”前沿生物稱(chēng)。